尋夢新聞LINE@每日推播熱門推薦文章,趣聞不漏接❤️
最近,上海澤生科技開發股份有限公司(下稱「澤生科技」)獲得了科創板審議受理,其致力於心力衰竭、消化系統平滑肌衰竭、神經系統衰竭等器官功能衰退/衰竭領域的重大疾病研究。申報稿顯示,公司目前無控股股東及實際控制人。
據招股書,公司創始人MING DONG ZHOU(周明東)、上海智有、陳鳳英、滕燕蘋合計持股13.65%的股份,張江科投及浦東新產投合計持股22.73%。而張江科投與浦東新產投受同一實際控制人浦東國資委控制。事實上,公司第一大股東其實為浦東國資委。

這家成立20年的公司,自主研發了全新機理、全新靶點的潛在國際首創新藥(First-in-Class)紐卡定®(重組人紐蘭格林),在研藥物紐卡定®是通過改善心肌細胞結構和心臟功能達到治療效果;公司在經營上主要依賴紐卡定®,同時上市之路似乎也遇到了一些困難。
存在累計未彌補虧損超7億 現金流承壓
首創新藥研發向來是具有高風險、高投入、回報周期長的特征。截至招股說明書簽署之日,澤生科技核心產品紐卡定®仍處於研發階段,公司目前尚未盈利並存在累計未彌補虧損7.72億元。
而報告期內,公司經營活動產生的現金流量淨額分別為-9,914.61萬元、-1.57億元、-1.20億元。另外,值得注意的是,報告期內,公司資產總額大幅度在減少,2017-2019年,公司資產總額分別為5.8億元、3.19億元、1.67億元。
由於公司目前尚無一款藥品上市,未來一段時間內,公司預計或仍將處於虧損狀態。申報稿顯示,2017-2019年報告期內,公司分別虧損1.12億元、1.48億元、1.63億元。
截至目前,澤生科技主要通過股權融資等方式獲取營運資金以及政府補貼。報告期內,公司收到的政府補貼金額分別為494.98萬元、411.58萬元、1,430.90萬元。
如果公司無法在未來一段期間內取得盈利或籌措到足夠資金,公司將被迫推遲、削減或取消公司的研發項目或未來的在研藥品商業化進度;若未能實現盈利將可能被終止上市的風險。
目前,除了新藥紐卡定®(慢性收縮性心力衰竭適應症)進入了中國臨床 III 期。其他4個主要在研新藥形成的6個在研項目中,1項處於臨床 III 期試驗階段,2項處於臨床II期試驗階段、1項正在準備申請臨床批件,2項處於臨床前研究階段(預計分別將於2021、 2022年申請臨床批件)。
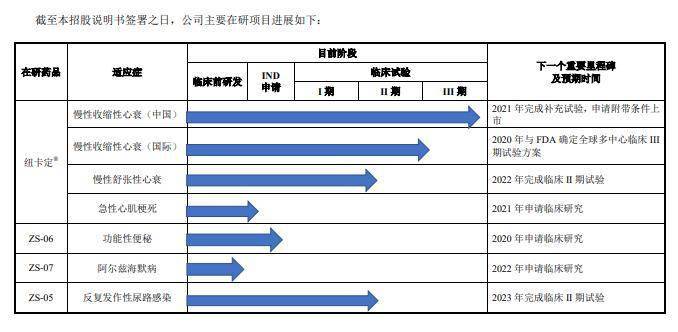
來源:申報稿
研發投入明顯不足,市場競爭激烈
相比於同行上市公司,澤生科技在研發上的投入較低且研發投入增長緩慢。報告期內,公司用於研發的費用分別為6,797.72萬元、7,054.82萬元、7,085.74萬元。
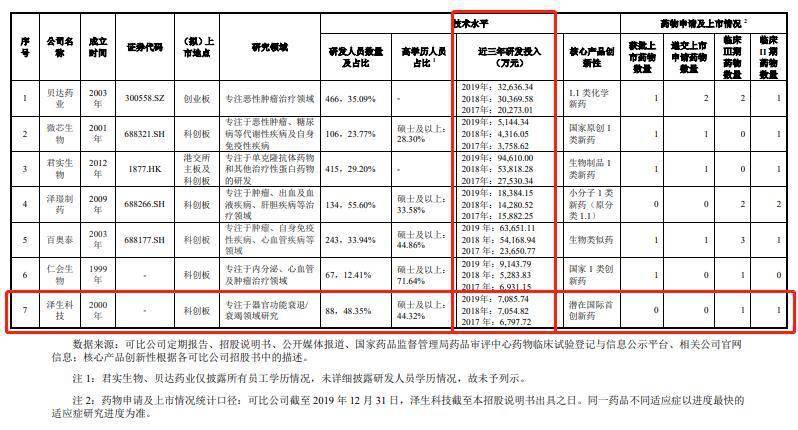
來源:申報稿
對此,澤生科技在申報稿中解釋,多年來公司重心在全新靶點、全新作用機制的原創新藥上,大量資金用於產品管線的臨床前研究、臨床試驗及新藥申報註冊等工作,以致於公司研發費用投入明顯不足。
而公司臨床試驗後期藥物少於可比公司,這對澤生科技來說,未來藥品若獲批上市,將可能面臨來自跟隨型藥物(Me-too或Me-better)、仿制藥、技術進步、替代療法、其他新藥物等多種因素形成的競爭。
此外,產品競爭不僅在藥品的臨床適應性上,對於澤生科技而言,紐卡定®新藥在藥品安全性、療效方面還需要一段時間來獲得醫學界、醫生、患者等各方的認可。以及紐卡定®所處的心衰行業的治療費用相對較高,是否列入國家醫保目錄對紐卡定®未來商業銷售具有重要影響。
核心產品面臨附條件上市挑戰
此外,原創性新藥由於靶點、作用機制等方面存在未知因素導致臨床開發不確定性高,藥監部門對於該類藥物的審評審批也會相對更謹慎。
2018年5月,澤生科技向國藥監局遞交紐卡定®慢性收縮性心力衰竭適應症的有條件上市申請,這一申請獲受理後並在2019年3月被納入優先審評。但藥監局藥品審評中心在2020年1月的批復認為,由於現有研究數據不足,因此對該附條件上市申請不予批準。
對此,依據藥監局在審批意見中的建議,澤生科技準備就紐卡定®慢性收縮性心力衰竭適應症補充開展一項以心功能為主要療效指標的臨床試驗研究(ZS-01-308),若該心功能確證性補充試驗結果證明紐卡定®(慢性收縮性心力衰竭適應症)的安全性和有效性,公司將再次申請紐卡定®(慢性收縮性心力衰竭適應症)附條件上市。
也就是說,澤生科技在研核心紐卡定®距離真正的商業化還要一段時間,且時間不確定性很高。
不過,截至招股說明書簽署之日,紐卡定®的中國確證性臨床III期試驗(ZS-01-306)正在進行中。若順利通過,紐卡定®距離上市將更近一步;而一旦獲得上市批準,商業化後的價值也會很可觀。
據悉,澤生科技此次募集資金15億元,將主要用於新藥的研發9.94億元和補充流動資金5.06億元。
【如果您還想了解更多財經資訊,點擊下載和訊財經APP,1500萬理財高手都在用】
