尋夢新聞LINE@每日推播熱門推薦文章,趣聞不漏接❤️
在癌症的臨床治療中,免疫檢查點抑制劑(Immune-checkpoint blockade,ICB)療法已獲得了巨大的成功。 然而,採用抗PD-1或抗CTLA-4單藥治療方案卻會出現一定程度的低響應率,因此,明確低響應率的原因及機制,並尋找提升ICB治療響應率的方法是目前研究的重點。
最近,由美國La Jolla免疫研究所Pandurangan Vijayanand教授所領銜的研究團隊在Nature Immunology期刊發表重要研究成果,他們首次揭示 抗PD-1治療將上調多種腫瘤組織浸潤的濾泡調節性T細胞(Tfr)的數量。Tfr細胞的克隆和分化過程與普通Treg細胞有很多相似性,但具有更強的免疫抑制能力和增殖能力。 在小鼠模型中,當Tfr細胞發育缺失,或先使用抗CTLA-4抑制Tfr細胞後,抗PD-1治療的抗腫瘤能力將顯著提高[1]。
這意味著, Tfr細胞的免疫抑制能力,是導致PD-1抑制劑低響應率的可能原因之一,將Tfr作為靶點,尤其是在PD-1抑制劑前使用CTLA4抑制劑,可能是破解免疫治療低響應率的關鍵。

論文首頁截圖
科學家已經發現,ICB治療低響應率很可能與腫瘤組織中浸潤的調節性T細胞(Treg)有關[2],腫瘤組織中Treg細胞數目升高的患者,生存率相對較差[3]。對Treg細胞進一步的研究發現,在次級淋巴器官中,其可進一步分化為表達PD-1的Tfr細胞亞型[4,5], 該亞型能夠限制淋巴生發中心功能[6],阻斷針對自身抗原的體液免疫反應,並具有比未分化Treg細胞更強的免疫抑制能力[4,5]。
在抗腫瘤免疫反應研究中,T細胞、B細胞及三級淋巴結構(TLS)的作用及其對抗PD-1治療的反應機制已有較多文獻報導。然而,抗PD-1治療對Tfr細胞的影響及機制尚無深入研究。本研究提出假說認為, 「Tfr細胞在腫瘤的三級淋巴結構中廣泛分布,表達具有針對自身抗原的T細胞抗原受體,而腫瘤細胞高度表達自身抗原,因此Tfr細胞將促進腫瘤細胞的免疫逃逸反應。」
研究人員首先整合了6種癌症類型的已公開的9個單細胞測序資料庫,對腫瘤組織中浸潤性CD4+T細胞進行了Meta分析,發現Treg細胞在腫瘤浸潤性CD4+T細胞中占有較高比例(約5-55%)(圖1A),而這些Treg細胞中約有5-30%為Tfr細胞(圖1B)。該研究進一步收集了肺癌患者組織樣本進行驗證,通過流式檢測,發現Tfr細胞在CD4+T細胞中的比例約為10-20%(圖1C)。 這說明Tfr細胞在多種癌組織中廣泛存在。
圖1 (A-B)不同單細胞測序資料庫中Treg細胞占CD4+T細胞比例(A)、Tfr細胞占Treg細胞比例(B);(C)肺癌組織中Tfr細胞占CD4+T細胞比例;
接著,研究者發現Tfr細胞高度表達CTLA-4及PD-1(圖2A),這意味著從機制上,抗CTLA-4治療可有效抑制Tfr細胞,而抗PD-1治療可能會激活Tfr細胞。
TLS及相鄰的B細胞、濾泡輔助性T細胞能夠增強抗腫瘤免疫[7,8],該研究發現Tfr細胞在TLS中的比例顯著高於腫瘤中的(圖2B), 說明Tfr細胞可能通過調控TLS形成,或抑制其相鄰的B細胞和濾泡輔助性T細胞,從而抑制抗腫瘤免疫。
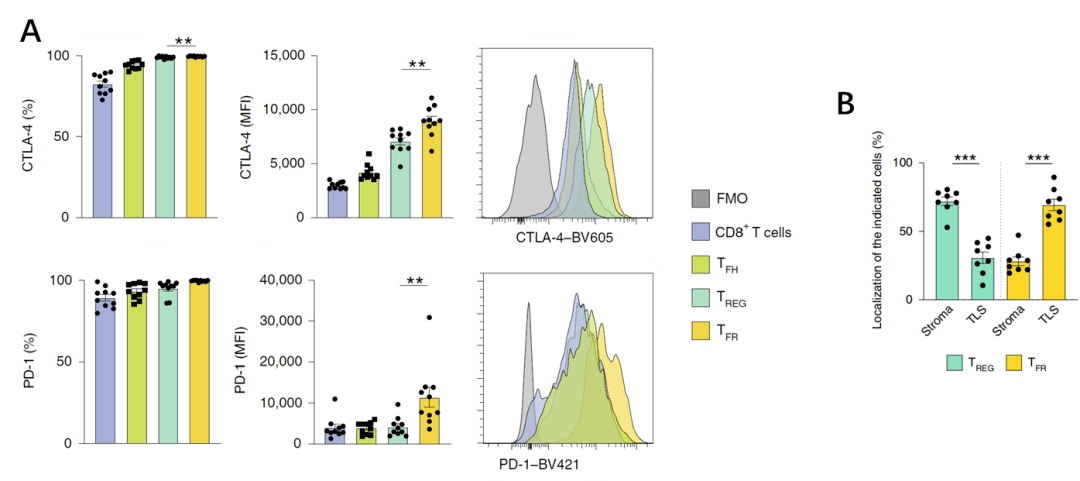
圖2 (A)Tfr細胞所表達的CTLA-4和PD-1水平;(B)TLS和腫瘤中Tfr細胞和Treg細胞比例;
研究人員進一步將人類腫瘤組織內Tfr細胞與Treg細胞進行單細胞測序對比,發現兩種細胞的克隆和發育相幹基因有高度相似性(圖3A), 但Tfr細胞的免疫抑制基因(CTLA4,TGFB1和IL10)和增殖基因(TOP2A和MI67)表達量更高(圖3B)。
接著,該研究探索了Tfr細胞對CD8+T細胞增殖能力的影響。研究者發現,無論是在小鼠體內實驗,還是體外共培養, 與Treg細胞相比,Tfr細胞抑制CD8+T細胞增殖及其分泌的功能分子的能力更強(圖3C)。
為進一步明確該免疫抑制能力對腫瘤的影響,研究者將CD8+T與Treg細胞或Tfr細胞過繼轉移至腫瘤小鼠體內,發現接受Tfr細胞的小鼠CD8+T細胞抗腫瘤免疫能力顯著降低、腫瘤體積增大(圖3D)。 這些研究表明 Tfr細胞比Treg細胞有更強的免疫抑制能力,可通過抑制CD8+T細胞而抑制抗腫瘤免疫。
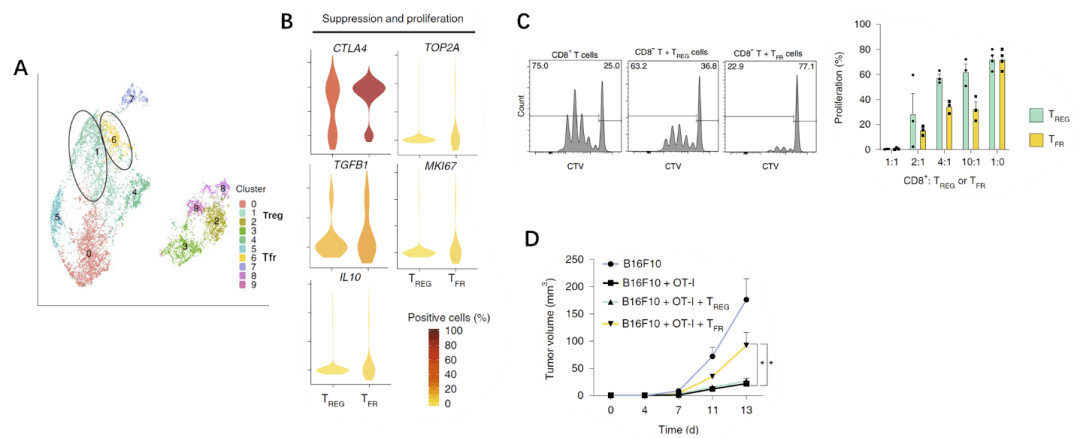
圖3 (A)測序數據主成分分析;(B)Tfr細胞及Treg細胞基因表達量比較;(C)Tfr細胞對CD8+T細胞的影響;(D)Tfr細胞對腫瘤體積的影響;
下一步,該研究探索了抗PD-1治療對Tfr細胞的影響,發現PD-1抗體會導致腫瘤中Tfr細胞顯著增高(圖4A)。為明確Tfr細胞對抗PD-1治療效果的影響,他們敲除了小鼠Tfr細胞(圖4B)、或使用抗CTLA-4抑制Tfr細胞數量及功能(圖4C),發現能夠進一步增強PD-1抗體對黑色素瘤的治療效果,腫瘤體積顯著減小, 提示在抗PD-1治療之前抑制Tfr細胞可有效提高免疫治療有效性。
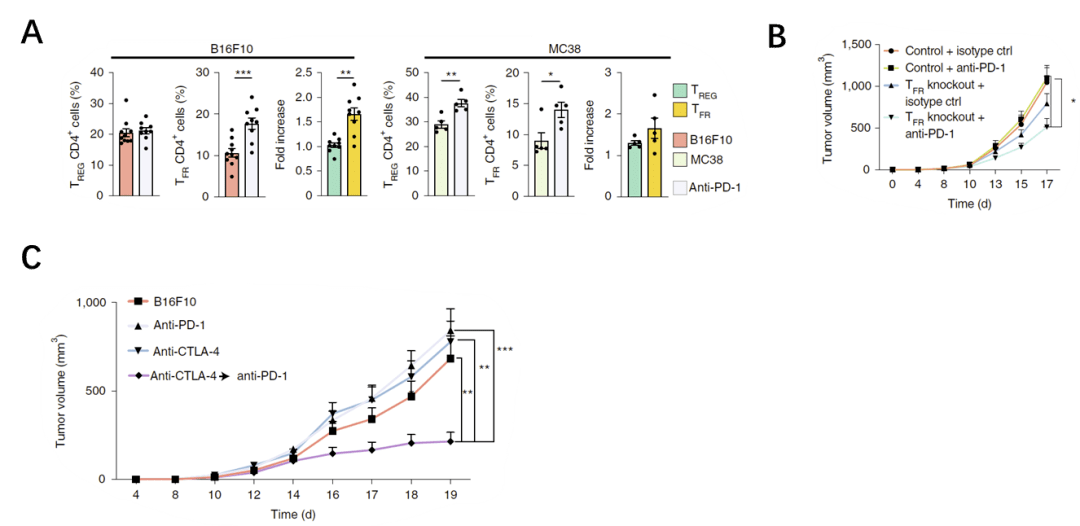
圖4 (A)抗PD-1治療對Tfr細胞的影響;(B)敲除Tfr細胞後,抗PD-1治療的抗腫瘤能力;(C)不同ICB治療方案的抗腫瘤能力對比;
最後,該研究收集了271名黑色素瘤患者的臨床研究數據,發現先使用抗CTLA-4治療,後使用抗PD-1治療的患者生存率顯著高於其它治療方案組(圖5)。 說明「先抗CTLA-4,後抗PD-1」貫續療法可能有效提高抗PD-1治療效果。
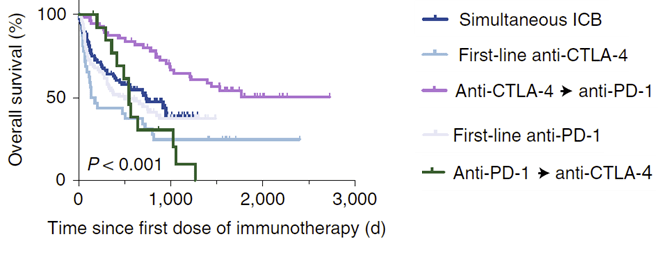
圖5 不同ICB治療方案存活率的隊列研究
綜上所述,Tfr細胞在多種癌組織中廣泛存在,具有更強的免疫抑制能力,抗PD-1治療將上調癌組織中Tfr細胞的數量;當Tfr細胞發育缺失,或先使用抗CTLA-4抑制Tfr細胞後,抗PD-1治療的抗腫瘤能力將顯著提高。
總的來說,該研究揭示了ICB治療低響應率的重要機制,發現了Tfr細胞對抗腫瘤反應的抑制作用。在臨床腫瘤免疫治療研究中,可以考慮驗證「先抗CTLA-4,後抗PD-1」序貫治療方案是否能夠有效提高響應率。

參考資料:
1.Eschweiler, S., et al., Intratumoral follicular regulatory T cells curtail anti-PD-1 treatment efficacy. Nat Immunol, 2021.
3.De Simone, M., et al., Tranional Landscape of Human Tissue Lymphocytes Unveils Uniqueness of Tumor-Infiltrating T Regulatory Cells. Immunity, 2016. 45(5): p. 1135-1147.
4.Sage, P.T., et al., The coinhibitory receptor CTLA-4 controls B cell responses by modulating T follicular helper, T follicular regulatory, and T regulatory cells. Immunity, 2014. 41(6): p. 1026-39.
5.Sage, P.T., et al., Circulating T follicular regulatory and helper cells have memory-like properties. J Clin Invest, 2014. 124(12): p. 5191-204.
6.Linterman, M.A., et al., Foxp3+ follicular regulatory T cells control the germinal center response. Nat Med, 2011. 17(8): p. 975-82.
7.Helmink, B.A., et al., B cells and tertiary lymphoid structures promote immunotherapy response. Nature, 2020. 577(7791): p. 549-555.
8.Hollern, D.P., et al., B Cells and T Follicular Helper Cells Mediate Response to Checkpoint Inhibitors in High Mutation Burden Mouse Models of Breast Cancer. Cell, 2019. 179(5): p. 1191-1206.e21.
本文作者 | 陳威威
