尋夢新聞LINE@每日推播熱門推薦文章,趣聞不漏接❤️
他們在一個遺傳性阿茲海默症家族中,發現了一個罕見的“天選之人”。
事情是這樣的,對於這個家族中攜帶致病突變的人而言,出現輕度認知障礙的中位年齡是44歲,癡呆開始的年齡是49歲 [2]。而這位“天選之人”竟然幸運地逃脫了癡呆魔咒,直到70多歲才出現輕度認知障礙。
推遲了30年左右。

▲圖源:Pixabay
研究人員深入研究這個罕見案例之後認為,這一切可能要歸功於她攜帶了極其罕見的純合基因突變:APOE3 的136號氨基酸由精氨酸變成了絲氨酸(R136S)。
更直白地說,科學家可能找到了一個能對抗阿茲海默症的基因突變。這個突變還有個意味深長的名字,Christchurch(基督城,新西蘭第三大城市)。
更為重要的是,研究人員竟然還在這位奶奶的大腦中發現了大量的β澱粉樣蛋白聚集。顯然這個發現又給“β澱粉樣蛋白理論”添堵了。
此外,研究人員還針對APOE的突變區域,設計了一個單抗,再現了APOE3 R136S突變的功能。這意味著,有可能針對這個新靶點,開發預防或者治療阿爾茨海默病的藥物。
同期發表的評論性文章認為,這項新研究為阿爾茨海默病的研究打開了一扇新的大門,研究背後的潛在治療方法有廣闊的應用前景[3]。

▲ 圖源:Pixabay
對於阿爾茨海默病,我想大家一定不需要我們再科普了。
在過去的一年裡,無論是《都挺好》裡的蘇大強,還是黃渤開的《忘不了餐廳》,都讓我們對阿爾茨海默病有了深刻的認知。
一個不爭的事實是,隨著老齡化速度的加快,阿茲海默症正在吞噬更多老年人的認知。
一個無奈的現狀是,已經有近20年沒有治療阿茲海默症的新藥獲批上市了。而之前獲批的5種療法,只能在一定範圍內改善患者的症狀,對於患者認知的衰退,作用非常有限。
知道了以上兩點,你就能明白,為什麼百健宣布aducanumab可能有效的時候,股價能大漲近40%;也能理解為什麼國家藥監局有條件批准甘露特鈉上市,能引起那麼大的轟動了。
可以說,阿茲海默症的治療領域還是一片空白。

▲ 圖源:hms.harvard.edu
而阿茲海默症的難治,與它的發病原因密切相關。
從目前科學家對阿茲海默症的認知來看,它是一種遺傳、表觀遺傳和環境共同作用的複雜疾病。學界有很多假說,其中最為著名的就是“β澱粉樣蛋白假說”、“tau蛋白假說”以及“病毒感染假說”等。
關於以上這些假說,我們精心打磨的音頻課程《醫學趨勢50講》裡面有詳細的介紹,想要深入了解阿爾茨海默病的朋友,不妨在看完文章之後,掃描文末二維碼試聽訂閱。
如果僅從基因的角度來看的話,編碼澱粉樣蛋白前體的APP基因、編碼早老素1的PSEN1基因和編碼早老素2的PSEN2基因等非常關鍵。
前三個基因如果突變的話,會導致早髮型常染色體顯性阿茲海默症(簡稱AD)。也就是說,只要攜帶突變,在40歲左右出現認知衰退的風險極高[2]。而且這些患者都有一個顯著的特點,那就是β澱粉樣蛋白在大腦中大量聚集。
因此,一個著名的假說就誕生了:上述基因突變導致的β澱粉樣蛋白聚集,會引起tau蛋白病變,進而促發阿茲海默症相關的認知功能下降。

▲ 該圖片由Gerd Altmann在Pixabay上發布
遺憾的是,無論科學家通過什麼方法消除大腦中的β澱粉樣蛋白或者tau蛋白,都不能阻擋認知衰退(希望百健的aducanumab是個例外)。這是讓人很絕望的。
在這種條件下,科學家只能“靠天吃飯”了。
大家別誤會,我這裡說的“靠天吃飯”,並不是說科學家等著天上掉特效藥;而是等特殊的患者。
如果從基因的角度講,某個本該患阿爾茨海默病的人,卻遲遲沒有患病的話,那麼他/她的體內一定藏著對抗阿爾茨海默病的秘密。
哈佛醫學院持續跟踪全世界最大ADAD家族數據庫[4]的Yakeel T. Quiroz團隊,抓住了機會。
在這個有1200名PSEN1 E280A突變攜帶者的哥倫比亞大家族中,出現了一個不一樣的人。據線人“舉報”,他們家族有個70歲的老奶奶,確定攜帶致病的PSEN1 E280A突變。然而,讓他們感到不解的是,在他們這個家族裡,攜帶這個致病突變的人毫無例外的都在44歲左右時出現輕度認知障礙,這個老奶奶卻躲過一劫,直到70多歲才出現記憶力衰退。
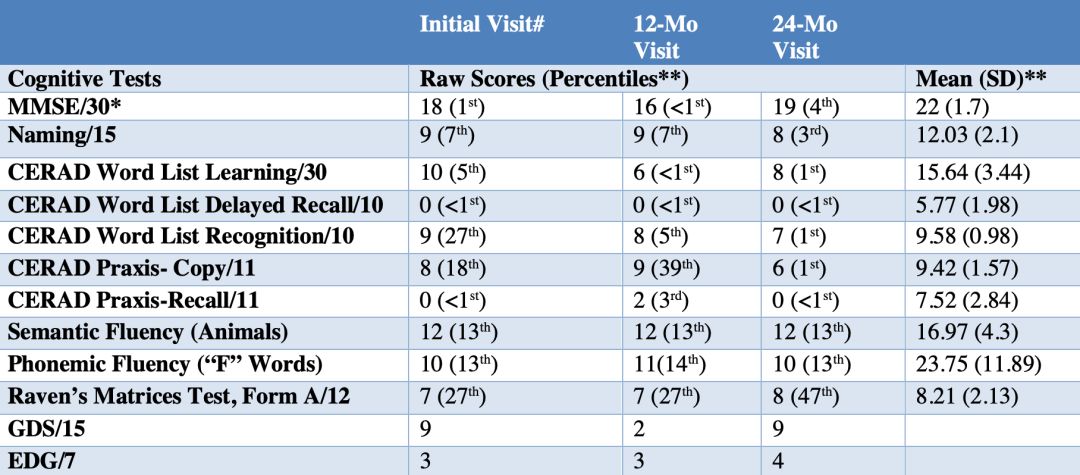
▲老奶奶的認知狀況
為了進一步確認老奶奶確實是致病突變攜帶者,研究人員給她做了全外顯子測序。結果表明,老奶奶確實是致病突變攜帶者。
於此同時,研究人員還在她的APOE3基因中發現了一個罕見的Christchurch突變,也就是136號氨基酸由精氨酸變成了絲氨酸(R136S)。實際上,這個突變類型之前在APOE2基因中出現過[5]。
由於Christchurch突變非常罕見,為了確認它的存在,研究人員又用桑格測序驗證了一遍。證實確實存在無誤之後,他們通過全基因組測序和Genomizer分析[6],確認PSEN1 E280A突變是老奶奶患ADAD的高危因素,而且APOE3上的純合R136S突變,可能就是她對抗ADAD的關鍵所在。
遺憾的是,在其他攜帶致病突變的人體內,再也沒有發現純合APOE3 R136S突變,只有4名在45歲出現輕度認知障礙的人是APOE3 R136S突變的攜帶者。
基於上面的數據,研究人員推測,只有純合的APOE3 R136S突變才能對抗致病突變對認知的傷害,而雜合的攜帶者,也不能逃脫致病突變的魔爪。
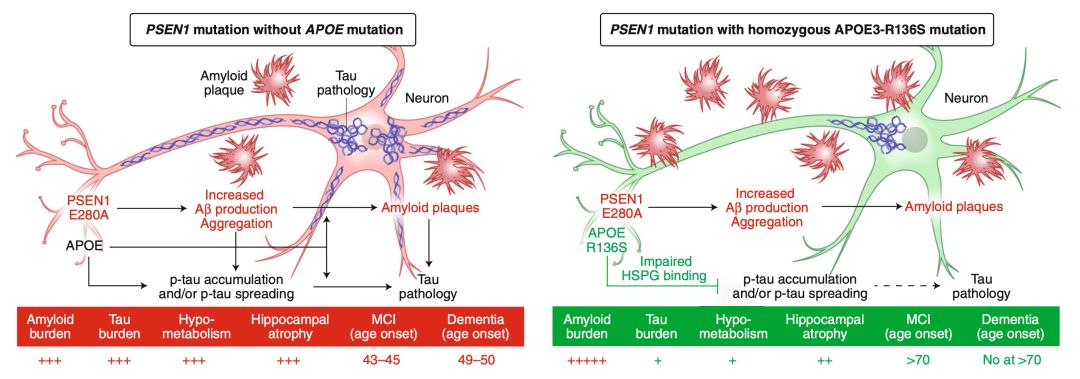
▲ 左圖沒有APOE保護突變,認知衰退;
右圖有APOE保護突變,沒有認知衰退
此處既然牽扯出了APOE3,我們就不得不稍微介紹下APOE基因了。APOE基因也是一個與阿爾茨海默病相關的基因,它有三個常見的等位基因:APOE2、APOE3和APOE4。
其中APOE3被認為與阿爾茨海默病沒啥關係,而APOE2則與阿爾茨海默病風險降低以及發病推遲有關,至於APOE4,它與阿爾茨海默病風險升高強相關[7]。
而APOE上的R136S突變,尤其是APOE2中的這個突變,與Ⅲ型高脂蛋白血症有關[8]。結果這個老奶奶確實有服用阿托伐他汀的歷史,不過她沒有被確診為Ⅲ型高脂蛋白血症。這回意外確診了,醫生讓她加大用藥劑量,還給開了一些其他的藥物輔助治療。
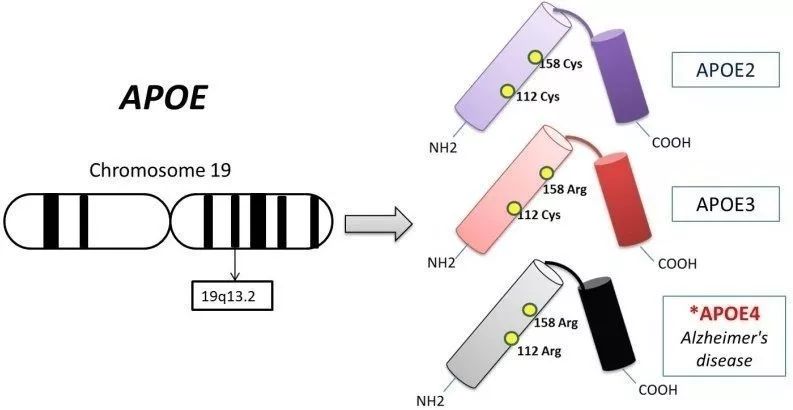
▲ APOE 的位置與三兄弟(autismweb2.com)
分子層面的事情差不多搞清楚了。那這個老奶奶的腦子裡面究竟發生了什麼呢?
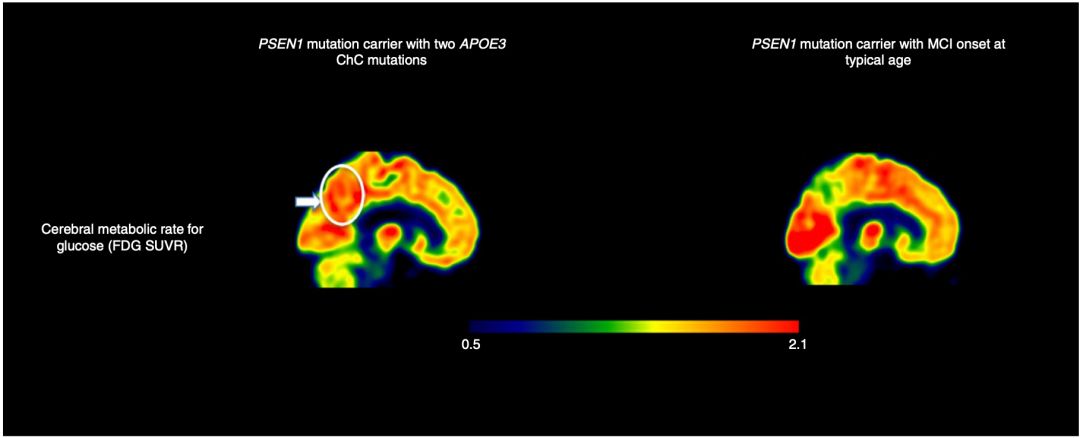
神經影像學結果很快就出來了,β澱粉樣蛋白異常升高,甚至比有致病突變但沒有APOE3 R136S保護突變的患者更高。看到這個結果不知道堅持“β澱粉樣蛋白理論”的科學家做何感想,開展相關藥物研發的企業又是怎麼想的。
不過,讓研究人員意外的是,儘管β澱粉樣蛋白的負擔非常高,但是tau蛋白的負擔很少,神經退行性病變的程度和範圍也非常有限。這暗示,APOE3 R136S突變的保護作用,是通過限制tau蛋白病變和神經病變實現的。
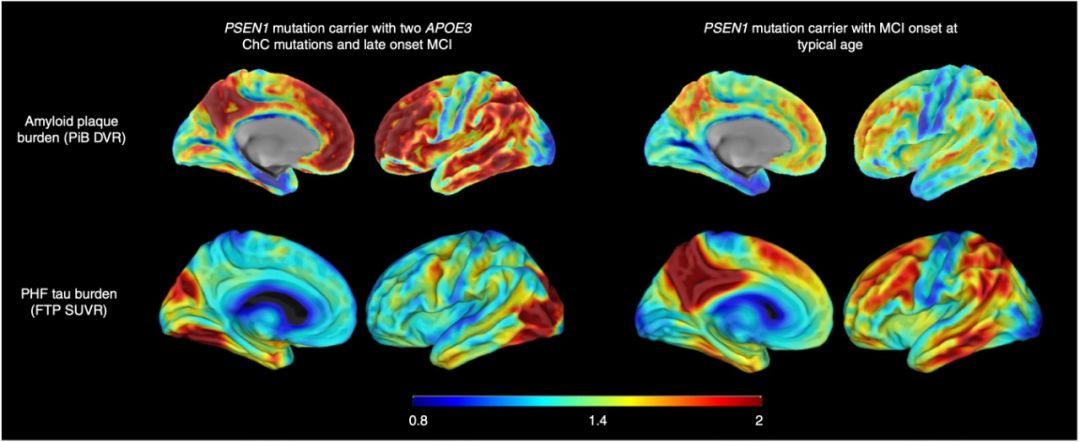
▲ 攜帶APOE3保護突變的大腦β澱粉樣蛋白負擔高,但tau蛋白水平低(左兩豎排)
至於這背後的機制,研究人員回顧了之前相關研究,發現這個R136S突變位於APOE3與脂蛋白受體和硫酸乙酰肝素蛋白聚醣(HSPG)結合的關鍵區域 [8]。還有科學家發現,HSPG可以促進β澱粉樣蛋白的聚集和神經元攝取胞外的tau,而APOE結合可能是其中某些作用所必需的 [9]。而Quiroz團隊也發現,與其他APOE亞型相比,APOE3 R136S與HSPG的結合能力最低。
由於APOE4與HSPG的結合能力超群[10],這有可能就是APOE4與阿爾茨海默病強相關的關鍵原因。
如果是這樣的話,針對所有APOE蛋白的130-143位氨基酸,設計一個單克隆抗體,豈不是就可以破壞APOE與HSPG的結合能力?
實驗證實,確實可行。
這就意味著,這或許是一種可行的預防或者治療阿爾茨海默病的方法。
不過,Quiroz團隊比我更有想像力。他們期待有一天能安全的編輯APOE基因,那樣就有望一勞永逸了。
▲ 左APOE3保護突變的保護作用
我想說的是,這個研究雖然振奮人心,但是也需要謹慎。因為截至目前為止,只發現了這一個特殊的純合突變患者。不排除是其他的原因推遲了她的阿爾茨海默病發病時間。無論如何,需要開展下一步的小鼠試驗,甚至是人體相關研究。
畢竟阿茲海默症這個領域實在是太能坑人了,不信你去看看《醫學趨勢50講》。
[1].Arboleda-Velasquez, JF, Lopera, F., O’Hare, M., et al. Resistance to autosomal dominant Alzheimer’s disease in an APOE3 Christchurch homozygote: a case report[J]. Nature medicine, 2019.
[2].Acosta-Baena N, Sepulveda-Falla D, Lopera-Gómez CM, et al. Pre-dementia clinical stages in presenilin 1 E280A familial early-onset Alzheimer’s disease: a retrospective cohort study[J]. The Lancet Neurology, 2011, 10(3): 213-220.
[3].https://www-nature-com.prxy4.ursus.maine.edu/articles/s41591-019-0634-9
[4].Quiroz YT, Sperling RA, Norton DJ, et al. Association between amyloid and tau accumulation in young adults with autosomal dominant Alzheimer disease[J]. JAMA neurology, 2018, 75(5): 548-556.
[5].Wardell MR, Brennan SO, Janus ED, et al. Apolipoprotein E2-Christchurch (136 Arg—-Ser). New variant of human apolipoprotein E in a patient with type III hyperlipoproteinemia[J]. The Journal of clinical investigation, 1987, 80(2): 483-490.
[6].Lalli MA, Bettcher BM, Arcila ML, et al. Whole-genome sequencing suggests a chemokine gene cluster that modifies age at onset in familial Alzheimer’s disease[J]. Molecular psychiatry, 2015, 20(11): 1294.
[7].Corder EH, Saunders AM, Risch NJ, et al. Protective effect of apolipoprotein E type 2 allele for late onset Alzheimer disease[J]. Nature genetics, 1994, 7(2): 180.
[8].Mahley RW, Huang Y, Rall S C. Pathogenesis of type III hyperlipoproteinemia (dysbetalipoproteinemia): questions, quandaries, and paradoxes[J]. Journal of lipid research, 1999, 40(11): 1933-1949.
[9].Rauch JN, Chen JJ, Sorum AW, et al. Tau internalization is regulated by 6-O sulfation on heparan sulfate proteoglycans (HSPGs)[J]. Scientific reports, 2018, 8(1): 6382.
[10].Yamauchi Y, Deguchi N, Takagi C, et al. Role of the N-and C-terminal domains in binding of apolipoprotein E isoforms to heparan sulfate and dermatan sulfate: a surface plasmon resonance study[J]. Biochemistry, 2008, 47(25): 6702-6710.
