尋夢新聞LINE@每日推播熱門推薦文章,趣聞不漏接
作者 | 垚淼鑫
來源 | 健識局(jianshiju01)
全文1469字,閱讀需3分鐘
2018年,對醫藥行業具有歷史意義的一年,大事件和重磅政策不斷,醫保局橫空出世,改革完善仿制藥供應保障及使用,進口抗癌藥零關稅及抗癌藥專項談判,強勢推進仿制藥一致性評價,長生生物疫苗事件,基藥新政和新版基藥目錄千呼萬喚始出來,帶量採購擴大試點……
每項政策措施都對未來醫藥行業的發展具有深遠影響,筆者僅挑選其中重點事件簡要概述之,以期拋磚引玉。
醫保局誕生
「三醫聯動」要來了
5月31日,在國家機構改革方案公布之後,新組建國家醫保局正式揭牌。這將整合了原來分散於人社、衛健、發改、民政等部門的相關職能,進一步理順了醫療保障制度在「三醫聯動」中的定位和基本功能,有利於充分釋放醫療保障制度對醫療資源配置結構和配置方式的調節作用。
至此,結束了過去「九龍治水」的局面,行政效率大大提高。業內普遍認為,醫保局集支付、監督、定價大權於一身,是貫徹醫改意志、執行醫改工作的國之利器。
組建國家醫保局,是為強力推進國家醫改鋪路。業內人士分析指出,大陸醫改成功的出路和方向在「醫保、醫藥和醫療」即「三醫」聯動下推進,破除以藥養醫。
帶量集采4+7試點
醫保控費出重拳,原研替代加速
11月15日,《4+7城市藥品集中採購文件》在上海陽光醫藥採購網正式公布,採購目錄共31個品種,多為慢病用藥和常見用藥。組織藥品集中採購試點的範圍包括了4個直轄市——北京、天津、上海、重慶和7個城市——瀋陽、大連、廈門、廣州、深圳、成都、西安共11個城市,因此簡稱為「4+7」。
帶量採購從通過了一致性評價(即仿制藥須與原研藥療效及質量一致)的仿制藥對應的通用名藥品中篩選試點品種入手,國家組織開展藥品集中採購試點,以此降低藥價,減少企業交易成本,引導醫院規範用藥。帶量採購,降低國家的醫療負擔和改變目前不合理的醫保支出結構,目的在於控制醫保費用。現行的醫保大部分的支出都用在了藥品上,相當一部分是給到了輔助用藥以及過期的專利藥、國內的仿制藥,如果不對其進行調整,創新藥、進口藥進入醫保的空間有限。
12月6日,帶量採購預中標結果公示,31個藥品的總體降價幅度超出了人們的預期,其中,降價幅度最大的是正大天晴的恩替卡韋,降幅超過90%。其中中標的外企僅有兩家,其餘全為國內企業。而仿制藥替代原研藥是降低國家醫保費用支出的重要手段。
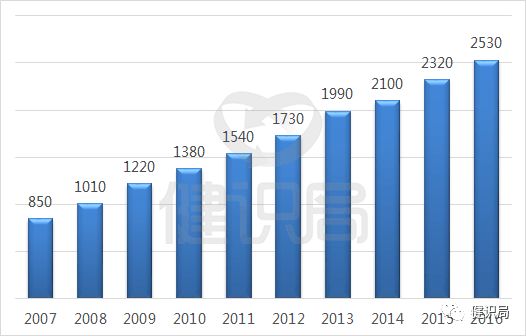
以世界用藥第一大國美國為例,根據美國的仿制藥推進經驗可以看出,由於政策支持和藥物可及性的逐步提高,過去十年,低價仿制藥為美國醫療衛生體系共計節省了16700億美元;2016年一年就節省了2530億美元,創歷史新高。
註:數據根據公開資料整理,供參考。
而在大陸,仿制藥替代原研只是剛剛起步,未來還有很長的路要走。但,不可否認的是,這一替代的進程在逐步加速。
仿制藥政策強勢推進
大批仿制藥批文將消失
4月3日,國家發布《關於改革完善仿制藥供應保障及使用政策的意見》明確,在促進仿制藥研發,提升仿制藥質量療效,提高藥品供應保障能力,更好地滿足臨床用藥及公共衛生安全需求,加快大陸由制藥大國向制藥強國跨越。
該文件中提出了加快推進仿制藥質量和療效一致性評價工作,細化落實鼓勵企業開展一致性評價的政策措施;藥品集中採購機構要按藥品通用名編制採購目錄,促進與原研藥質量和療效一致的仿制藥和原研藥平等競爭。
12月28日,國家藥監局官網發布了《國家藥品監督管理局關於仿制藥質量和療效一致性評價有關事項的公告(2018年第102號)》,同時發布《關於仿制藥質量和療效一致性評價有關事項的公告》政策解讀,明確提出「時間服從質量,合理調整相關工作時限和要求」。但是,主要是指「289基藥目錄」的年末大限取消,不是無限期要求,而是更加明確了要加強管理。化學藥品新註冊分類實施前批准上市的含基本藥物品種在內的仿制藥,自首家品種通過一致性評價後,其他藥品生產企業的相同品種原則上應在3年內完成一致性評價。逾期未完成的,企業經評估認為屬於臨床必需、市場短缺品種的,可向所在地省級藥品監管部門提出延期評價申請,經省級藥品監管部門會同衛生行政部門組織研究認定後,可予適當延期。逾期再未完成的,不予再註冊。
雖然國家藥監局已經取消年底大限,但從相關政策文件和目前進展情況來看,大批批文消失仍是必然。根據相關政策文件規定,一旦一個藥品有一家企業通過一致性評價後,其他企業需要在3年內完成,如果逾期未完成的則不再予以註冊。根據國家的政策導向,也就意味著這些批文將會成為無用批文或被註銷。而大陸當前有大量仿制藥品種的批文高度重復,這些將是批文消失的重災區。
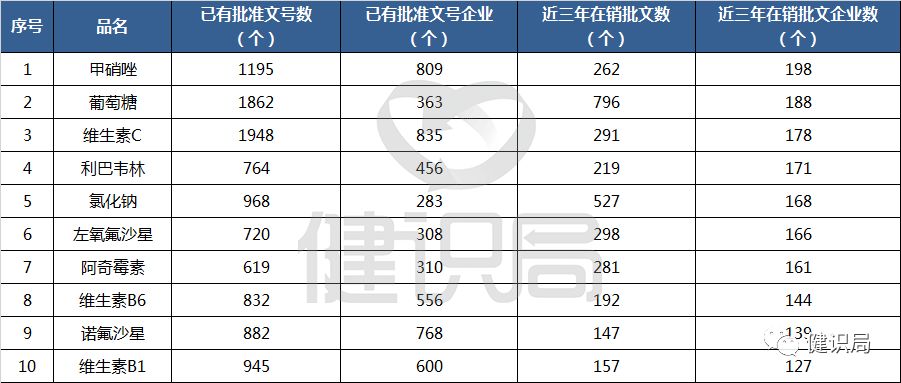
根據2018年年初原CFDA發布的大陸過度重復的藥品提示信息顯示,大陸同一個品種批文數超過20個的品種有近300個。其中,批文數、企業數、近三年在銷批文數和在銷批文企業數均在120個以上的品種就有10個。有甲硝唑、葡萄糖和維生素C品種的批文數量竟在1000條以上,重復程度之高令人怎麼舌。
註:根據國家藥監局公開資料整理,供參考。
腫瘤藥市場大變局
千億市場格局重塑
◆ 進口腫瘤藥零關稅實施,「狼」真的來了
4月12日國務院常務會議決定:從2018年5月1日起,將包括抗癌藥在內的所有普通藥品、具有抗癌作用的生物鹼類藥品及有實際進口的中成藥進口關稅降至零,並較大幅度降低抗癌藥生產、進口環節增值稅稅負。
實施零關稅不是目的,目的是為了降低國內腫瘤患者的負擔。
根據財政部2017年關稅稅率數據顯示,大陸進口藥品最惠國稅率為2%-4%,而普通稅率最高則可達80%,此外還有增值稅17%。而藥企一般均會將這些成本轉嫁給國內患者。
將該類藥品進口稅率調整為0,一方面有利於腫瘤藥藥品進入中國市場和降低進口藥品價格,減輕患者負擔;但另一方面「狼」真的來了,國內的抗腫瘤靶向藥市場還不成熟,國內腫瘤藥企的發展將進一步承壓。
◆ 腫瘤藥醫保專項談判,市場格局將重塑
8月17日,國家醫保局發布2018年抗癌藥醫保準入專項談判藥品範圍,確定將18個品種(16個進口品種,2個國產品種),涉及的非小細胞肺癌、結直腸癌、腎細胞癌、黑色素瘤、慢性粒細胞白血病、淋巴癌、多發性骨髓瘤等多個癌症急需用藥納入談判。最終17個藥品談判成功,其中絕大多數是腫瘤靶向藥。
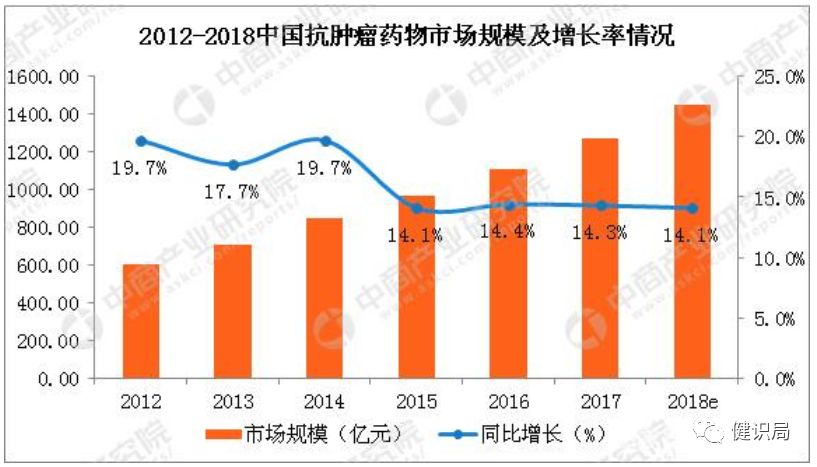
在全球藥品市場腫瘤藥市場規模已經多年高居各治療領域的榜首,而據預測其市場地位將會持續。在大陸,腫瘤藥市場也在千億以上,位居各疾病治療領域的前列,近半數卻依賴進口。據數據統計,2012年-2016年中國抗腫瘤市場由603億元增長至1109億元,年均復合增長率約為16.5%,預計2018年市場規模可達1447億元,未來十年的市場空間依然很大。
註:數據來源於中商產業研究院。
但是,在大陸腫瘤藥市場中有較大份額的腫瘤中成藥、免疫調節劑等輔助性用藥。根據貝達藥業IPO招股書顯示,在2015年大陸近千億的腫瘤藥市場中,腫瘤靶向藥的市場規模僅為120億元,不到整個腫瘤藥市場的1/5。
腫瘤靶向藥受到國家醫保政策的鼓勵,2017年談判成功的36個品種中,其中有半數是腫瘤用藥,預計這些品種2017年在中國市場合計規模已超過100億元,其中靶向腫瘤藥預計占80%的份額。預計隨著進口腫瘤藥零關稅和醫保談判政策的實施,靶向腫瘤藥市場有望迎來大爆發,逐步與國際市場格局靠攏。
基藥新政和新基藥目錄發布
基層用藥市場大變局
9月19日,國務院辦公廳發布了《國務院辦公廳關於完善國家基本藥物制度的意見》指出,要強化基本藥物「突出基本、防治必需、保障供應、優先使用、保證質量、降低負擔」的功能定位,明確提出要動態調整優化目錄,並明確提出動態調整至少三年一次,除少數民族地區可增補少量民族藥外,原則上各地不得增補品種。該基藥新政是繼289個口服基藥一致性評價以來最為重磅的基藥政策。
在基藥新政發布1個月後,新基藥目錄於10月25日正式發布,2018版基藥目錄共調入藥品187種,調出22種(其中有17個為化藥),目錄總品種數量由原來的520種增加到685種,其中西藥417種、中成藥268種。

新版基藥目錄更加注重各層級醫藥市場的對接,而不再像之前的基藥目錄一樣,基藥品種一定是醫保品種。新增的品種中,包括吉非替尼、伊馬替尼、埃克替尼、利妥昔單抗、曲妥珠單抗、培美曲塞、卡培他濱等,也成為此次的新增抗腫瘤藥品種。根據米內網數據顯示,新基藥目錄新增品種2017年國內終端銷售額合計超1500億元,化學藥品及生物制品共119個(按通用名計算),其中有11個為非醫保品種;新增中成藥共70個;而調出22個品種中有2個為中成藥。
其中,119個新增的化學藥品及生物藥品2017年在中國城市公立醫院、縣級公立醫院、城市社區中心及鄉鎮衛生院(簡稱中國公立醫療機構)終端以及中國城市零售藥店終端的合計銷售額已經高達1363億元。其中重磅品種恩替卡韋、阿托伐他汀市場規模在100億元以上,布地奈德、瑞舒伐他汀以及培美曲塞等品種的銷售額也在50億元以上。
70個新增的中成藥2017年在上述終端的合計銷售額接近200億元。其中,超過10億元的大品種有百令膠囊(片)、金水寶膠囊(片)、華蟾素片(膠囊)、蘇黃止咳膠囊以及消痛貼膏。
由於此前地方根據需要大量增補基藥品種,而這些增補往往成為灰色地帶,提供了尋租的空間。基藥新政和新基藥目錄實施後,地方基本不再增補品種,加之諸多重磅品種的調入,基層用藥市場格局將發生劇變。
顯然,2018年醫藥行業的大事件和重點政策還有很多,限於篇幅和筆者的能力,僅就其中的部分簡述一二,難免掛一漏萬,敬請讀者補充、討論、批評、指正。
編輯:Shirley
END
星標
